La electrólisis es cualquier proceso químico no espontáneo causado mediante la corriente eléctrica. Las sustancias iónicas pueden conducir corriente eléctrica cuando se encuentran en soluciones acuosas.
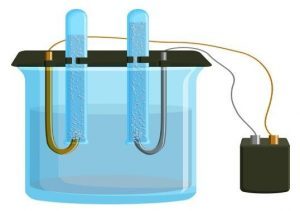
La electrólisis proviene de esta propiedad iónica, es decir, es un proceso donde hay pérdida de carga por parte de aniones y cationes (descarga de iones).
La electrólisis es una transformación artificial, porque es causada por un generador, pero tiene una enorme importancia práctica. Tiene un gran uso en industrias, en la producción de muchas sustancias, entre ellas metales alcalinos, alcalinotérreos, hidrógeno y cloro.
Características
- Es un proceso químico.
- El electrolito se disuelve en un solvente determinado.
- Los iones de carga opuesta se mantienen atraídos gracias a cada electrodo.
- Hay transferencia de electrones.
- Mediante un par de electrodos se aplica una corriente continua.
Ejemplos
La electrólisis es un proceso útil para obtener varios elementos químicos. Por ejemplo:
- Sodio: electrolisis ígnea de NaCl (cloruro de sodio) fundido en un proceso que se produce a unos 800°C.
- Aluminio: electrólisis ígnea de Al2O3 (bauxita).
- Soda cáustica (NaOH): electrolisis acuosa de NaCl (cloruro de sodio).
- Hidrógeno: electrólisis acuosa de NaCl (cloruro de sodio).
- Cloro: electrolisis ígnea del cloro gaseoso (Cl2). El cloro se utiliza mucho en la producción de compuestos orgánicos clorados y blanqueadores, y también para el tratamiento de agua potable y piscinas.
Observación: La electrólisis ígnea es el paso de la corriente eléctrica en una sustancia iónica en estado de fusión, a diferencia de la electrólisis acuosa en la que el paso eléctrico se produce a través de un líquido conductor.
Importancia
La electrólisis se utiliza mucho en la galvanoplastia, es decir, para cubrir objetos con una fina capa de metal. Varios cationes metálicos, después de la reducción, se adhieren al cátodo, lo que provoca la formación de una capa metálica. Por ejemplo:
- Niquelado: recubrimiento de un objeto con níquel.
- Cromado: revestimiento de un objeto con cromo.
Tiene un gran uso en industrias, en la producción de muchas sustancias, tales como metales alcalinos, metales alcalinotérreos, hidrógeno y cloro.
Leyes de la electrólisis
Las Leyes de la Electrólisis fueron desarrolladas por el físico y químico inglés Michael de Faraday (1791-1867). Ambas leyes rigen los aspectos cuantitativos de la electrólisis.
Primera ley
La primera Ley de Electrólisis dice lo siguiente:
«La masa de un elemento, depositada durante el proceso de electrólisis, es directamente proporcional a la cantidad de electricidad que pasa a través de la célula electrolítica».
Segunda ley
La segunda Ley de Electrólisis dice que:
«Las masas de varios elementos, cuando se depositan durante la electrólisis por la misma cantidad de electricidad son directamente proporcionales a sus respectivos equivalentes químicos».
Pilas y la electrólisis
La electrólisis se basa en un fenómeno inverso al de las pilas. En la electrólisis, el proceso no es espontáneo, como en las pilas. En otras palabras, la electrólisis convierte la energía eléctrica en energía química, mientras que la pila genera energía eléctrica a partir de la energía química.
Aplicaciones de la electrólisis
Muchos materiales y compuestos químicos se producen a partir del proceso de electrólisis, por ejemplo:
- Aluminio y cobre
- Hidrógeno y cloro en cilindro
- Bisutería (proceso de galvanización)
- Olla a presión
- LLantas de magnesio (tapacubos de los coches)